

Das Atom wurde von den griechischen Philosophen Leukipp und Demokrit als kleinster, unteilbarer Baustein aller Materie angesehen. Erst sehr viel später entdeckte man, dass das Atom sehr wohl teilbar ist und aus einem Atomkern und einer Atomhülle besteht. Man entdeckte, dass die Atomhülle negativ geladene Elektronen enthält und der Kern insgesamt positiv geladen ist. Ebenfalls entdeckte man, dass nahezu die gesamte Masse eines Atoms im Kern konzentriert ist. Im Verlauf der weiteren Entwicklung entdeckte man, dass auch der Kern aus zwei unterschiedlichen Bestandteilen zusammengesetzt ist: den positiv geladenen Protonen und den ungeladenen Neutronen.

Protonen und Neutronen haben fast die gleiche Masse, wobei Neutronen etwas schwerer sind. Beide Bausteine des Atomkerns sind etwa 1800mal schwerer als ein Elektron.
Masse des Elektrons: me = 9,1 · 10-31 kg
Masse des Protons: mp = 1,6726 · 10-27 kg
Masse des Neutrons: mn = 1,6749 · 10-27 kg
Der Atomkern besteht aus einer bestimmten Anzahl von Protonen und einer dazugehörigen Anzahl von Neutronen. Wie viele Neutronen zu der Protonenzahl gehört, hängt u.a. von der Protonenzahl ab. Es gilt zunächst, dass für die kleineren Atomkerne die Anzahl der Neutronen und der Protonen gleich ist. Je größer ein Atomkern wird, desto größer ist der Anteil der Neutronen.
Beide Bestandteile des Atomkerns werden zusammenfassend auch Nukleonen genannt.
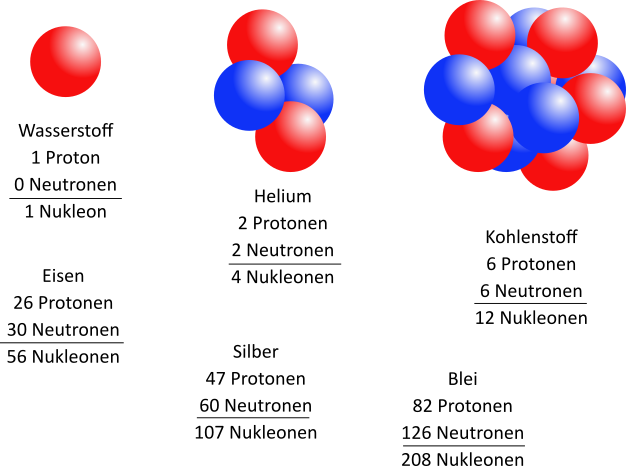
Die Anzahl der Protonen definiert das Element, das durch diese Atome gebildet wird. Sie reicht von 1 (Wasserstoff)
bis 118 (Oganesson). Die Neutronenzahl kann für jedes Element variieren.
Man nennt Atome, die unterschiedliche Neutronenzahlen bei gleicher Protonenzahl aufweisen, Isotope des
Atoms. Isotop bedeutet "gleicher Ort" oder "gleiche Stelle", was darauf zurückzuführen ist,
dass Isotope eines Atoms immer die gleiche Protonenzahl beinhalten und damit zum gleichen Element gehören. Sie
befinden sich also an der gleichen Stelle im Periodensystem der Elemente. Isotope eines Atoms sind chemisch
nahezu identisch.
Isotope mit der "richtigen" Neutronenzahl sind stabil. Ist die Neutronenzahl nicht "richtig", d.h. sind weniger als die richtige Anzahl oder mehr als die richtige Anzahl im Kern vorhanden, ist der Kern instabil und zerfällt im Lauf der Zeit. Mit dem Zerfall verändert sich der Kern, und zwar so, dass das Zahlenverhältnis der Protonen und Neutronen eher passt als vorher. Der Kern entwickelt sich nach und nach zu einem stabilen Kern.
Da sich bei dem Zerfall des Kerns auch die Anzahl der Protonen verändern kann, verändert sich u.U. also auch das Element.
© mondbrand MMXIX