

Zunächst sollen die verschiedenen Leitungsmechanismen an Hand eines Teilchenmodells erläutert werden. Unter einem Teilchenmodell
wird dabei verstanden, dass sich alle Effekte (oder besser: fast alle) durch das Verhalten von Teilchen, festen Kugeln, o.ä.
erklären lassen.
Für die Teilchenmodelle ist es wichtig, dass die Bindungsmechanismen, d.h., die Frage: "Wie bilden sich eigentlich die verschiedenen
Materialien?" entweder bekannt sind oder zusätzlich kurz erläutert werden.
Das Bestreben aller in der Natur vorkommenden Prozesse ist es, einen energetisch möglichst günstigen Zustand zu erreichen. Bei der Frage der
Bindungen zwischen Atomen ist das der Zustand einer gesättigten äußersten Elektronenschale eines jeden Atoms. Atome mit einem oder zwei
Elektronen auf der äußersten Schale sind sehr reaktiv. Sie möchten gern diese Valenzelektronen abgeben, so dass sie dann eine
volle äußerste Schale besitzen. Atome, denen nur ein oder zwei Elektronen fehlen, um die äußerste Schale zu füllen, sind ähnlich reaktiv, da
sie nur zu gern die fehlenden Elektronen aufnehmen.
Die meisten Metalle besitzen nur wenige Valenzelektronen. Um nun einen Festkörper zu bilden, setzen sich die Atome in einer für
das Material typischen Weise in einer Kristallgitterstruktur zusammen. Dabei werden von allen Atomen die jeweiligen Valenzelektronen an den
Gesamtverband abgegeben, also nicht von einer anderen Atomsorte aufgenommen. Es bildet sich statt dessen ein sogenanntes Elektronengas, das
aus über das gesamte Metall gleichmäßig verteilten Elektronen besteht.
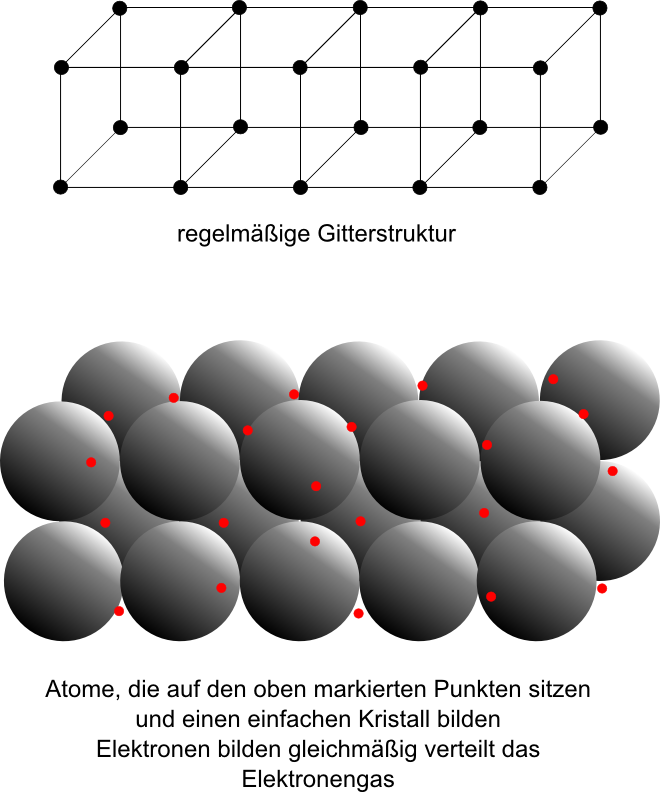
Metalle sind typischerweise in einer gitterförmigen Struktur gebundene, positiv geladenen Atomrümpfe
zwischen denen ein Gas aus quasi-freien Elektronen besteht.
Aus diesem Bindungsverhalten entstehen die metallischen Eigenschaften, wie z.B. metallischer Glanz oder gute Leitfähigkeit. Es ist zu beachten,
dass einzelne Atome keine metallischen Eigenschaften aufweisen können. Die Eigenschaften entstehen erst durch die metallische Bindung, d.h. durch
die positiven Atomrümpfe in der Gitterstruktur und dem negativen Elektronengas.
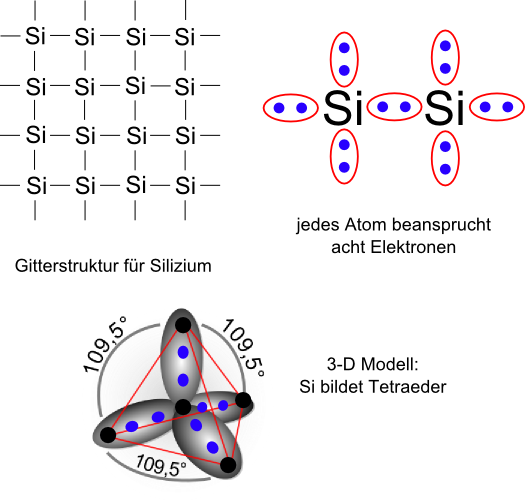
Die kovalente Bindung wird wichtig bei der Beschreibung des Leitungsmechanismus bei Halbleitern, insbesondere bei Silizium. Die Bindung entsteht
dadurch, dass sich Atome die Valenzelektronen teilen. Am Beispiel Silizium heißt das, dass jedes Si-Atom mit seinen vier Valenzelektronen vier
weitere Elektronen benötigt, bzw. vier Elektronen abgeben müsste, um eine gesättigte äußere Schale aufzuweisen.
Benachbarte Si-Atome teilen sich somit jeweils zwei Elektronen. Der Kristallaufbau von Si liefert vier direkte Nachbarn für jedes Si-Atom.
Damit kann jedes Atom seine äußere Schale absättigen (4 Nachbarn x 2 Elektronen = 8 Elektronen).
Bei der Ionenbindung gibt ein Atom seine Valenzelektronen an ein anderes Atom ab. Beide sättigen so ihre äußere Schale. Ein Atom wird zu
einen negativen Ion, durch die Aufnahme von Elektronen, das andere Atom wird zu einem positiven Ion, indem es Elektronen abgibt.

Die Unterscheidung, ob ein Material ein Leiter ist oder ein Halbleiter, ist willkürlich. Sie wird anhand der Leitfähigkeit
des Materials getroffen. Die Grenzen der einzelnen Bereiche sind fließend, es gelten aber ungefähr die folgenden Werte:
| Leiter | Halbleiter | Nichtleiter |
|---|---|---|
| > 108 S/m | 108 - 10-6 S/m | < 10-6 S/m |
© mondbrand MMXIX